7月7日,CFDA官网一日发布5条涉及医疗器械的通知,以督促各省食药监局对辖区内因飞检有问题的械企整改情况,这次继上月23日一天发布8条通知督促10家械企整改之后,又一次集中发布通知。
此次,涉事的6家医疗器械公司包括:
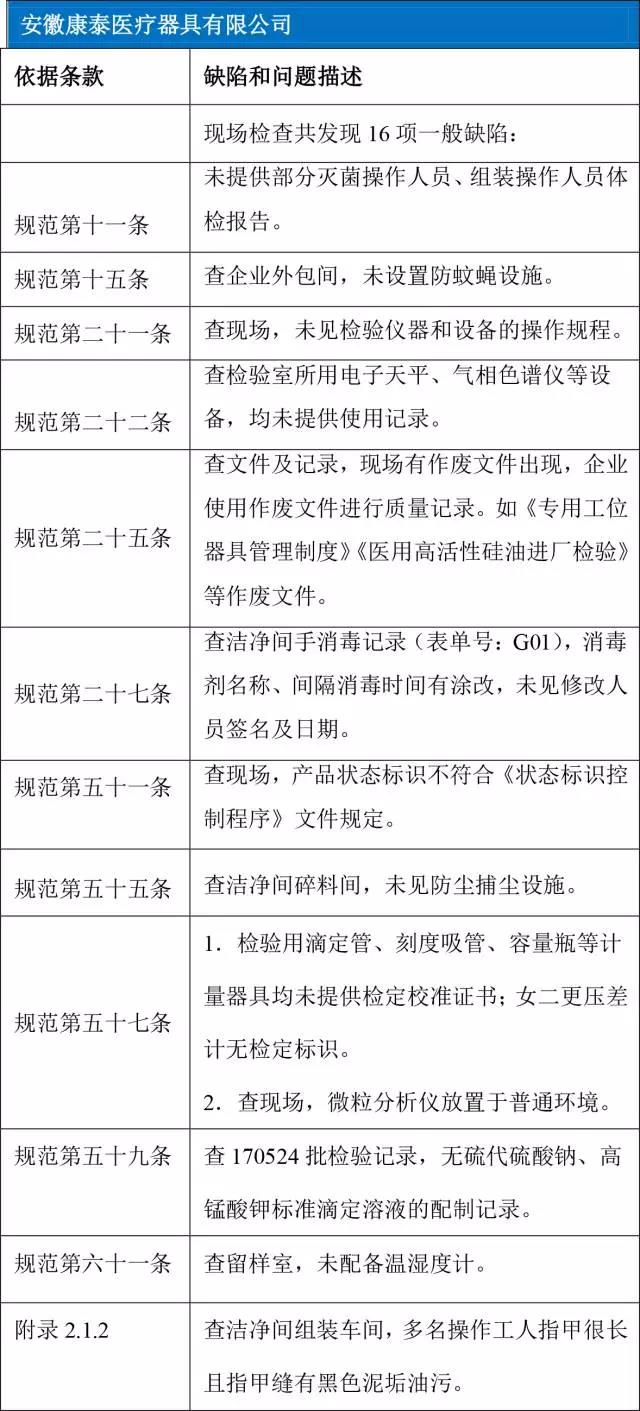
安徽康泰医疗器具有限公司
甘肃辰旭医疗科技有限公司
山东侨牌集团有限公司
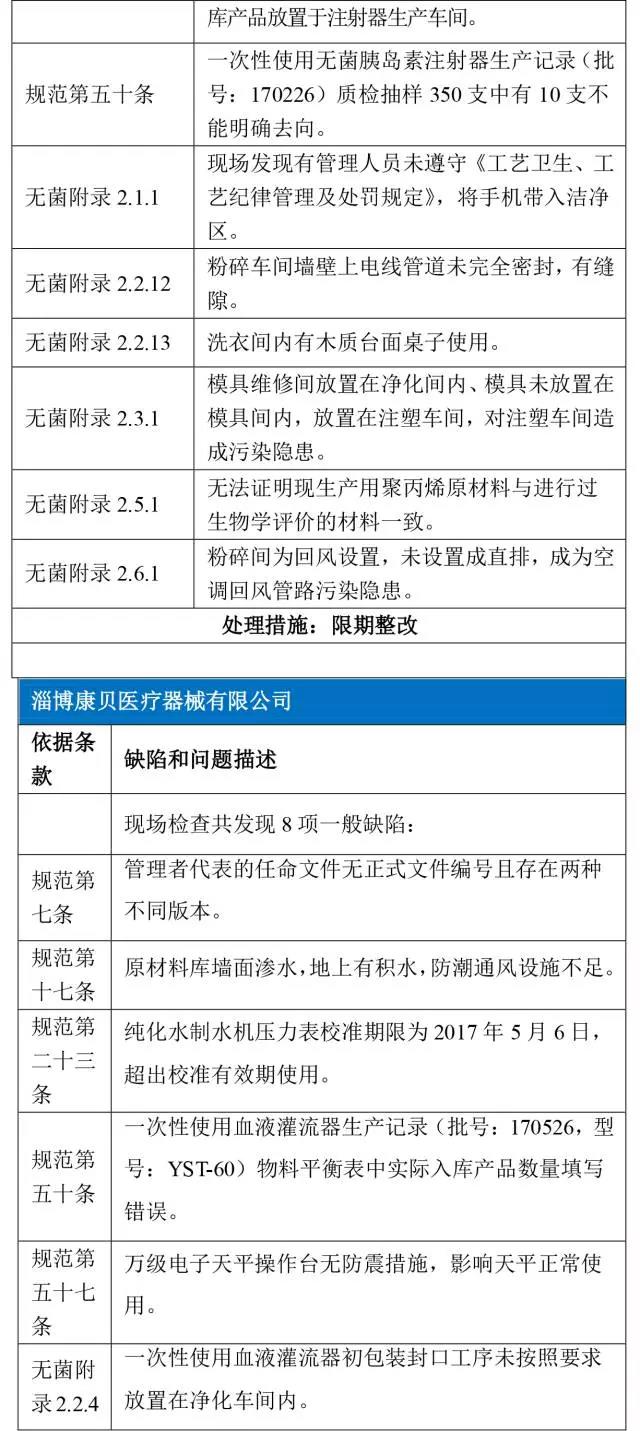
博康贝医疗器械有限公司
普林斯顿医疗科技(珠海)有限公司
深圳市益心达医学新技术有限公司
其中,除了甘肃辰旭医疗、普林斯顿医疗因自主申请停产之外,其余的4家公司受到的相应处理措施均为“限期整改”。
针对4家需要限期整改的械企,CFDA要求相关省食药监局责成企业限期整改,必要时跟踪复查,评估产品安全风险,对有可能导致安全隐患的,应按照《医疗器械召回管理办法》的规定,召回相关产品。
CFDA同时要求相关省食药监局对检查中发现问题的企业要加大监督检查频次和力度。
对于停产企业,CFDA则要求企业恢复生产前应当按照有关规定书面报告相关省食药监局,经局核查符合要求后方可恢复生产。
以下是6家械企在飞检中出现的“问题”汇总。



(来源:赛柏蓝器械)
